22日、薬食審の医薬品等安全対策部会安全対策調査会が開催され、コデイン類の小児等への使用制限が決まったそうです。
平成29年度第3回薬事・食品衛生審議会医薬品等安全対策部会安全対策調査会
(厚労省 2017.06.22)
資料:http://www.mhlw.go.jp/stf/shingi2/0000168841.html
コデインリン酸塩等の小児等への使用制限について(案)
http://www.mhlw.go.jp/file/05-Shingikai-11121000-Iyakushokuhinkyoku-Soumuka/0000168848.pdf
これは、コデイン類が肝代謝酵素CYP2D6 により、活性代謝産物であるモルヒネ及びジヒドロモルヒネ(以下「モルヒネ等」という。)に代謝され、鎮咳等の薬効を示すものの、遺伝的にCYP2D6の活性が過剰である者(Ultra rapid metabolizer:UM)では、モルヒネ等の血中濃度が上昇し、呼吸抑制等が発現しやすくなる可能性があるとした知見による対応で、指摘は10年以上前から行われています。
当サイトの関連記事:TOPICS
2007.08.18 TOPICS コデイン服用後の有害事象は遺伝子の型によって左右される
海外では、この知見による対応は早く、英国では2010年10月に18歳未満、カナダでは2013年6月に12歳未満への使用制限が勧告されています。
当サイトの関連記事:TOPICS
2010.10.13 コデイン含有咳止め液剤は18歳未満は使用すべきでない(英国)
2013.06.07 12歳未満は、コデイン配合製品を使用しないよう勧告(カナダ)
その後、各国は独自のレビューを行い下記のようなアナウンスを行っています。
| 規制機関名 | 発出日 | タイトル |
|---|---|---|
| 英MHRA | 2010.10.06 | Codeine-containing liquid over-the-counter medicines. |
| Health Canada | 2013.06.06 | Health Canada’s review recommends codeine only be used in patients aged 12 and over |
| EMA | 2013.06.28 | |
| 2015.03.13 | PRAC recommends restrictions on the use of codeine for cough and cold in children | |
| 英MHRA | 2015.04.29 | Codeine for cough and cold: restricted use in children |
| ニュージランドMedsafe | 2015.04.29 | Changes to the use of bromhexine or codeine-containing cough and cold medicines in children |
| 豪TGA | 2015.10.01 | ACSOM meeting statement |
| シンガポールHSA | 2016.12.20 | Restrictions on the use of codeine-containing products in children and adolescents |
| 米FDA | 2017.04.20 | FDA Drug Safety Communication: FDA restricts use of prescription codeine pain and cough medicines and tramadol pain medicines in children; recommends against use in breastfeeding women |
安全対策調査会の資料にもあるように、ようやく日本でもレビューを開始し、今回の決定に至ったわけですが、懸念は、「国内における小児の呼吸抑制のリスクは欧米と比較して遺伝学的に低いと推定される。また、コデイン類含有製剤によると疑われる死亡例の副作用報告はされていない」「コデイン類を含有しない製剤に切り換える方針であるが、準備に相当の時間を要する」「現在処方している医師に対し、呼吸抑制に関する注意を周知徹底するための一定の経過措置期間を設定すべき」などとして、2年近くの経過措置が設けられたことです。
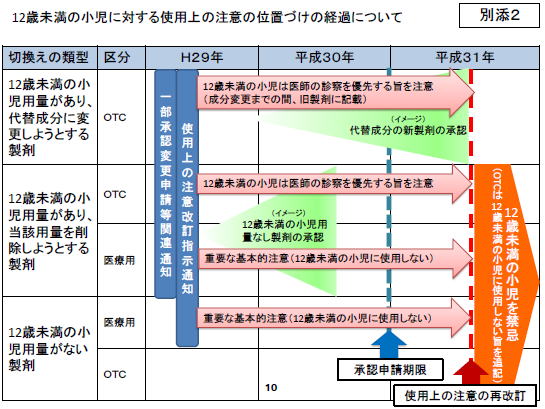
上記の猶予期間のOTC販売時の対応は、添付文書にこれまでの対応が明記されるだけで、基本的に現在と変わりません。(関連記事→TOPICS 2009.11.11 2012.08.16)
また、OTC代替品の承認販売までの猶予の必要性は理解できますが、OTCメーカーがこれまで風邪薬・咳止めというと、コデイン製剤に頼りすぎていた感も否めません。
一方、小児科学会が周知期間が必要としていますが、小児科を専門としない医師が子どもを診察する際に、この注意喚起がどこまで周知されるかは大いに疑問です。
コデインについては、英MHRAのPublic Assessment Report – Oral liquid cough medicines containing codeine: should not be used in children and young people under 18 years では、今回の迅速代謝の問題だけでなく、「気管支収縮作用があり、慎重な使用が必要」といった問題があります。ツイッター上でも下記のような指摘があり、最大2年もの周知期間が本当に必要なのか疑問に思いました。
コデインがもうすでに子どもにはヤバい薬だとわかっていた十数年前、気管支炎にコデインを処方された児が呼吸不全に陥り、気管支鏡をしてもらったら気管支の樹状の形そのまんまに固まった痰が吸引されてきたことがある・・・ https://t.co/JfVIQqpT11
— kamekura@エグゼイ聴診器作った (@kamekurasan1) 2017年5月17日
呼吸抑制もそうですが、気管分泌を減らし痰の水分量が減り、結果痰が固くなって排出できず呼吸不全になるという印象が強くて、僕自身はコデインは処方したことないです。 「コデイン」含んだ医薬品 12歳未満への使用禁止へ | NHKニュースhttps://t.co/gpKoVEgwG5 https://t.co/ELCeAXU6OT — kamekura@エグゼイ聴診器作った (@kamekurasan1) 2017年6月23日
一方、コデインについては海外では依存性の問題も指摘されています。
英国では2009年9月、コデイン・ジヒドロコデインが配合されているOTC製品について、濫用や依存性の危険性が高いとして、効能の一部削除などの安全対策を行うと発表。(パッケージの正面にはっきりと ’Can Cause Addiction. For three days use only’ という表示を義務など)
関連情報:TOPICS
2009.09.04 ジヒドロコデイン配合OTC風邪薬,事実上使用禁止へ(英国)
また、豪州では、これらの問題に加え、依存性の潜在的リスクなども問題などから、各方面からの反対に関わらず、2018年2月からのコデインの処方箋医薬品化を決定しています
Final decision on re-scheduling of codeine: frequently asked questions
(豪TGA 2016.12.10)
https://www.tga.gov.au/final-decision-re-scheduling-codeine-frequently-asked-questions
この決定にあたっては、潜在的リスクのレビューやさまざまな影響を調べた報告書をまとめています
Regulation impact statement: Codeine re-scheduling
https://www.tga.gov.au/book/export/html/733435
ちなみに今回の日本における調査結果報告書(PMDA 2017.06.16)
http://www.mhlw.go.jp/file/05-Shingikai-11121000-Iyakushokuhinkyoku-Soumuka/0000168849.pdf
どうも今回の日本の対応は、海外の後追いという感が否めません。今回の決定にあたっては、上記のような報告書もまとめるべきではなかったかと思います。
注意喚起は経過措置期間の適切な対応策でしょうが、処方する医師、OTCを販売する薬剤師や登録販売者、これらを使用する患者や生活者に対しても、この2年間により強力な周知が必要ではないでしょうか。それが行われなければ、新たな問題が起こるような気がしてなりません。
>アジア人は欧米人に比べ、遺伝的に呼吸抑制の発現頻度が低いとされ
とありますが、その理由から副作用症例が少なく死亡例もないのですか?
副作用報告の制度が現場に徹底されておらず、副作用症例の拾い上げができていない、ということはないのでしょうか? https://t.co/nagDbFU3eN— 高橋 秀和 (@chihayaflu) 2017年6月22日
今朝のコデインのニュース見て、子供の市販薬にコデインが使われていることをはじめて知った医師や病院薬剤師も結構いるような気がする。 医師とかにヒアリングすると、コデイン入りの子供用市販薬のあることを話すと驚いた反応を方、少なくないですね。 — クスリ早見帖 (@hayamichou) 2017年6月23日
猶予期間を設ける意味がわかりません。もともと市販薬としてどうかという議論があった成分なのですから、予めデキストロメトルファンに切り替えておく方法もあったわけです。自社開発のPBにはリンコデを使わないドラッグストアもあります。お達しがでてから動くのは悪癖ではないでしょうか。 https://t.co/fs8SH5n2ve — kuriedits (@kuriedits) 2017年6月23日
6月24日 9:10更新
2017年06月24日 01:13 投稿

関連のブログ記事やツイートをいくつか紹介します。
小児科ではやはり現状でもほとんどコデインは使われていないようです。
やはり、60歳以降の医師の認識や、OTCについての懸念が多いようです
小児で禁止薬剤になる「コデイン」って何だ?!
(ぐんぐんキッズクリニック理事長のブログ 2017.06.23)
https://ameblo.jp/waffle-rijicho/entry-12286242213.html
添付文書改訂の指示が発出されています
使用上の注意改訂情報(平成29年7月4日指示分)
http://www.pmda.go.jp/safety/info-services/drugs/calling-attention/revision-of-precautions/0322.html
医療用は、
[慎重投与]の項の「乳児、高齢者、衰弱者」の記載を
「高齢者、衰弱者〔高齢者、衰弱者は代謝・排泄機能が低下しているため、 副作用が発現するおそれがある(「高齢者への投与」の項参照)。〕」
と改め、[重要な基本的注意]の項に
「重篤な呼吸抑制があらわれるおそれがあるので、12歳未満の小児には投与しないこと(「小児等への投与」の項参照)。」
「重篤な呼吸抑制のリスクが増加するおそれがあるので、18歳未満の肥満、閉塞性睡眠時無呼吸症候群又は重篤な肺疾患を有する患者には投与しないこと。」
を追記し、[小児等への投与]の項を
「12歳未満の小児には投与しないこと。〔呼吸抑制の感受性が高い。海外において、12歳未満の小児で死亡を含む重篤な呼吸抑制のリスクが高いとの報告がある。〕」
と改める。
一般用は
「次の人は服用前に医師、薬剤師又は登録販売者に相談すること
次の診断を受けた人。
呼吸機能障害、閉塞性睡眠時無呼吸症候群、肥満症」
を追記し、
「服用後、次の症状があらわれた場合は副作用の可能性があるので、直ちに服用を中止し、この文書を持って医師、薬剤師又は登録販売者に相談すること
まれに下記の重篤な症状が起こることがある。その場合は直ちに医師の診療を受けること。
呼吸抑制:
息切れ、息苦しさ等があらわれる。」
を追記し、[用法及び用量に関連する注意]の項の「2歳未満の乳幼児には、医師の診療を受けさせることを優先し、止むを得ない場合にのみ服用させること」の記載を
「12歳未満の小児には、医師の診療を受けさせることを優先すること」
と改める。