すでに、各種メディアやブログ等でさまざまな形で伝えられていますが、毎日新聞は27日、政府・与党が薬の審査・承認、薬害患者の被害救済などを受け持つ「医薬品庁」(仮称)の設置に向けた検討に入ったと伝えています。
今回の構想は、薬害肝炎事件の発生及び被害拡大の経過及び原因等の実態についての検証や再発防止のための医薬品行政の見直し等について提言することを目的として設置された「薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会」の中間とりまとめを受けて行われるもので、毎日新聞によれば、厚労省の医薬品の承認や安全対策を受け持つ厚労省医薬食品局の一部(審査管理課、安全対策課など)を本省から切り離して、薬などの審査を行っている独立行政法人「医薬品医療機器総合機構」(PMDA)と統合したうえで、医薬品庁などの新しい行政組織とするようです。
中間とりまとめでは、「承認審査、安全対策、副作用被害救済等の業務を一括して厚生労働省医薬食品局(現状。別の組織もあり得る。)が行い、審議会が大臣へ答申する。」とするA案と「承認審査、安全対策、副作用被害救済等の業務を一括して総合機構が行い、同機構が大臣へ答申する。」とするB案が示されましたが、それぞれのメリット・デメリットについての意見が示され、委員会としての意見もまとまっていませんでした。今回の報道の通りだとするとB案に近いものが採用となるようです。
薬害再発防止のための医薬品行政のあり方について
−早期に実施が必要な対策−中間とりまとめについて
(厚労省2008年7月31日)
http://www.mhlw.go.jp/shingi/2008/07/s0731-9.html
薬害再発防止のための医薬品行政のあり方について
−早期に実施が必要な対策−中間とりまとめ(案)
(第4回薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会資料)
http://www.mhlw.go.jp/shingi/2008/07/dl/s0707-8b.pdf
日本における医薬品の市販後安全対策は、先ず、製薬企業が医薬品の安全性の確保を図り、それを踏まえて、国は企業を指導・監督するとともに自らも安全対策を実施するという形で行われていますが、薬事法に基づき企業及び医療機関から厚生労働省に報告される分析・評価の対象とされている安全性情報等については、平均的には1日あたり、副作用等症例(国内)約130件、副作用等症例(海外)約380件、海外措置報告・研究報告6〜7件に達しています。下記表から見ても、欧米の規制当局と比較して人員などの日本における体制が脆弱である現状があり、これが相次ぐ薬害事件の発生につながっているのではないかとの指摘が行われています。
●医薬品・医療機器規制当局の審査・安全対策関係人員の国際比較
第2回薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会資料より引用
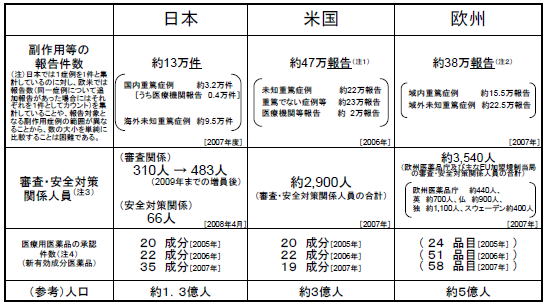 今後、現在66人しかいない安全対策を担当する職員(医薬品の副作用等情報の分析・評価及び安全対策措置の実施に携わる職員数に限ると、厚労省で15人、PMDAで20人にすぎない)を大幅に増員する(欧米における審査・安全対策に係る人員を参考に、安全対策全体で少なくとも300人程度の増員が必要とする事務局案が示されるものの異論も続出)ことになるようですが、毎日新聞では、職員の身分を国家公務員とするか、非公務員型の組織とするかは未定だとしています。
今後、現在66人しかいない安全対策を担当する職員(医薬品の副作用等情報の分析・評価及び安全対策措置の実施に携わる職員数に限ると、厚労省で15人、PMDAで20人にすぎない)を大幅に増員する(欧米における審査・安全対策に係る人員を参考に、安全対策全体で少なくとも300人程度の増員が必要とする事務局案が示されるものの異論も続出)ことになるようですが、毎日新聞では、職員の身分を国家公務員とするか、非公務員型の組織とするかは未定だとしています。
安全対策を担当する職員増などの体制の強化の動きには国民・患者、医療関係者にとって歓迎する動きですが、同時に副作用情報の収集のあり方や情報提供のあり方についても具体的な検討を行ってもらいたいものです。特に、オンライン報告の簡素化や米国や英国のような、患者が直接副作用報告ができるような仕組みを作ることは、市販後の副作用情報の収集には有用なはずです。
中間とりまとめ案でも、「医療の第一線の医師等から一次的な情報を得る等のために、医療機関から直接、副作用等の情報が国に報告されることも重要である。しかしながら、近年、副作用等報告に占める医療機関報告の割合が低下している。」「米国やオランダ等においては、患者からの副作用等報告の仕組みがあるが、我が国は、企業及び医療関係者からの報告を対象とした制度にとどまっている。」「「患者向医薬品ガイド」の医療関係者及び国民への周知が不十分である。」と指摘し、安全性に関する情報収集の充実・強化や「患者向医薬品ガイド」の活用などの患者への情報発信の強化などが早期に実施が必要な安全対策として盛り込まれています。
●自民党の動きについては、下記ページを参考にして下さい。
医薬品庁構想(藤井もとゆきHP もとゆきTALKその3)
http://www.mfujii.gr.jp/modules/talk/index.php?content_id=7
薬事政策のあり方についての検討方向
(自由民主党・社会保障制度調査会・薬事政策のあり方検討会 2008年4月10日)
http://www.mhlw.go.jp/shingi/2008/06/dl/s0605-4c.pdf
(第2回 薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会参考資料)
どうなる「医薬品庁」構想−“着地点”は未だ見えず
(薬事日報 HEADLINE NEWS 2008年6月20日)
http://www.yakuji.co.jp/entry7148.html
●薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会
| 開催日 | 議題 | |||
|---|---|---|---|---|
| 第1回 | 2008年5月23日 | 1.薬害肝炎事件の検証について 2.医薬品行政の見直しについて |
資料 | 議事録 |
| 第2回 | 2008年6月5日 | 医薬品行政の見直しについて (1)薬害肝炎被害者からのヒアリング (2)早期実施が必要な対策のための論点について |
資料 | 議事録 |
| 第3回 | 2008年6月30日 | 薬害再発防止のための医薬品行政のあり方について −早期に実施が必要な対策−中間とりまとめ(案) |
資料 | 議事録 |
| 第4回 | 2008年7月7日 | 薬害再発防止のための医薬品行政のあり方について −早期に実施が必要な対策−中間とりまとめ(案) |
資料 | 議事録 |
関連情報:TOPICS
2008.02.19 イエローカードオンライン副作用報告システムが本稼動(英国)
keywords:患者向け医薬品情報
参考:毎日新聞7月27日
http://mainichi.jp/select/science/news/20080727k0000m010109000c.html
医薬の行政改革、組織の在り方に議論錯綜(CBニュース6月6日)
http://www.cabrain.net/news/article/newsId/16457.html
薬害の再発を防止できるか(上)(CBニュース7月1日)
http://www.cabrain.net/news/article/newsId/16881.html
薬害の再発を防止できるか(下)(CBニュース7月2日)
http://www.cabrain.net/news/article/newsId/16896.html
医薬品の安全対策、約300人増員へ(CBニュース7月8日)
http://www.cabrain.net/news/article/newsId/16998.html
8月5日リンク追加
2008年07月27日 15:20 投稿

厚労省では、今年10月以降、薬害肝炎事件の検証とそれを踏まえた再発防止策の検討を行うことを予定していますが、9月22日、国民の皆様の御意見を参考として議論を深める観点から、「中間とりまとめ」及び薬害再発防止のための医薬品行政のあり方についての意見募集を開始しました。
「薬害再発防止のための医薬品行政のあり方について(中間とりまとめ)」に関するご意見の募集について
現時点では、意見・情報受付締切日は設定されていません。